科普知识:原电池与电解池技术总结
(1)原电池是把化学能转变为电能的装置。原电池中电子流出的一极是负极,通常是活泼性 相对较强的金属,电极本身被氧化,如Zn,Cu,H2SO4原电池中的锌片,Zn-2e-= Zn2+。电 子流入的一极是正极,通常是活泼性相对较弱的金属或非金属导体。电极上发生还原反应。 如2H++2e-= H2。在原电池中电子从负极流出经过导线流入正极,与电流的方向相反。
(2)原电池的构成条件 一是有两种活泼性不同的金属(或其中一种非金属导体)作电极。二是用导线连接的两电极与 电解质溶液接触并形成闭合回路。三是在电解质溶液中能自发地发生氧化还原反应。
(3)原电池的电极、电池反应式的写法。
① 铅蓄电池:负极为Pb,正极为PbO2,电解质溶液为硫酸。 负极(Pb):Pb+SO42--2e-= PbSO4 正极(PbO2):PbO2+4H++SO42-+2 e-= PbSO4+2H2O 电池反应:Pb+PbO2+2H2SO4= 2PbSO4+2H2O
② 银—锌高能电池:由负极为Zn,正极为Ag2O,电解质为KOH溶液。 负极(Zn):Zn-2 e-+2OH-= ZnO+H2O 正极(Ag2O):Ag2O+2 e-+H2O = 2Ag+2OH- 电池反应:Zn+Ag2O = ZnO+2Ag
③ 宇宙飞船上使用的氢氧燃料电池。H2为负极,氧气为正极,电解质为KOH溶液。 负极(H2):2H2-4 e-+4OH-= 4H2O 正极(O2):O2+4 e-+2H2O = 4OH- 电池反应:2H2+O2= 2H2O
(4)金属的腐蚀和防护
① 金属腐蚀的本质是金属原子失去电子被氧化:M-n e-= Mn+
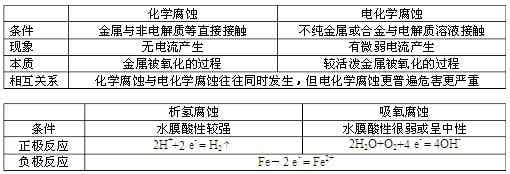
② 金属腐蚀的类型及比较
③ 金属腐蚀快慢的判断:
a.电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐蚀措施的腐蚀;
b.同一种金属的腐蚀:强电解质>弱电解质>非电解质
④ 金属的防护方法:
(1)改变金属的内部结构
(2)覆盖保护层
(3)电化学保护法
电解池
(1)电解和电解池 使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程叫做电解。电解质溶液的导 电过程,就是电解质溶液的电解过程。这种把电能转变为化学能的装置叫做电解池。
(2)电解池两极的确定和电极反应(电解CuCl2溶液) 阳极:接直流电源的正极。较易失去电子的阴离子优先在阳极(惰性)失去电子发生氧化反 应 。如2Cl--2 e-= Cl2
阴极:接直流电源的负极。较易得到电子的阳离子优先在阴极得到电子发生还原反应。如 Cu2++2 e-= Cu 电解反应式:Cu2++2Cl-电解==== Cu+Cl2
(3)离子的放电顺序
① 在阳极上如是活性材料作电极时,金属在阳极失电子被氧化成阳离子进入溶液。如是惰性 电极如Pt、石墨等,溶液中阴离子放电顺序是:S2->I->Br->Cl->OH->NO3->SO42->F-。
② 在阴极上无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离 子,阳离子在阴极上放电顺序是:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+> Al3+>Mg2+>Na+>Ca2+>K+。
(4)电解原理的应用
① 电解饱和食盐水制H2、Cl2和NaOH溶液。
② 电镀:
阴极:镀件。
阳极:镀层金属,阳极本身参加反应
电镀液:含镀层金属阳离子的电解质溶液。
③ 冶炼活泼金属:电解法炼铝、钠、镁等活泼金属。
④ 精炼铜:以精铜作阴极,粗铜作阳极,硫酸铜溶液作电解液。
(5)电解和溶液的PH值的变化规律(惰性电极):
① 含氧酸、可溶性碱、活泼金属的含氧酸盐溶液电解时,实质是电解水。 阳极:4OH--4 e-
= 2H2O+O2 阴极:2H++2 e-= H2 总反应式:2H2O电解 ====2H2+O2 电解含氧酸的水溶液(如H2SO4,HNO3),其PH值减小。
电解可溶性碱的水溶液(如NaOH,KOH),其PH值变大。
电解活泼金属的含氧酸盐溶液时,其PH值不变。
② 无氧酸溶液及不活泼金属的无氧酸盐(HF除外)溶液电解时,实际上是电解质本身的电解。 2HCl电解 ====H2+Cl2 PH值变大
③ 活泼金属的无氧酸盐溶液电解时,阴极放出H2,阳极有非金属单质析出,同时阴极区呈 碱性,溶液的PH增大。 2NaCl+2H2O电解 ====2NaOH+H2+Cl2
④ 不活泼金属的含氧酸盐溶液电解时,在阴极有金属单质析出,阳极有O2产生,同时阴极 区酸性增强,溶液的PH减小。 2CuSO4+2H2O电解 ====2Cu+O2+2H2SO4


