尖晶石型5V锂离子电池正极材料LiMn1.5Ni0.5O4的研究进展
锂电世界讯,目前已经大规模生产并商业化应用的锂离子电池正极材料仍然是LiCoO2,但社会的进步将会对锂离子电池提出更高的要求,比如:环境友好、成本低、安全性能好、高能量密度、高功率密度和优良循环性能等,显然LiCoO2已经不能满足社会的需要。锂离子电池的发展机遇与挑战并存,而且一直是近十年来的研究热点[1~4]。目前,锂离子电池正极材料正处于快速发展阶段,层状结构、尖晶石结构及橄榄石结构的正极材料是锂离子电池正极材料的主要研究领域。目前被业界看好的锂离子电池正极材料主要有LiCoO2、LiNi0.8Co0.2O2、LiMn2O4、LiNi1/3Co1/3Mn1/3O2、LiFePO4等,但这些正极材料的放电电压平台都小于4V,要获得高电压,就必须将多个单电池串联起来,就会出现维护不便,安全性不好的问题,这必然会影响到电池的功率密度和能量密度。而具有低成本, 环境友好, 安全性好等优点的LiMn2O4的放电电压虽有4.1V[5,6],但由于存在Jahn-Teller效应,故它的充放电容量以及循环稳定性都不理想。
研究者发现当向LiMn2O4掺入少量的过渡金属离子时,即LiMxMn2-xO4( M = Co、Cr、Fe、Cu、Ni)所获得的材料不仅存在4V平台,而且在5V附近也存在一个平台。其中,4V平台对应着Mn3+/ Mn4+电对的氧化-还原过程,而5V附近的平台对应过渡金属离子M2+/ M3+、M2+/ M4+或M3+/ M4+电对的氧化-还原过程,这些电对对应的氧化还原电位如表1所示。结合有关个氧化还原电对的相对能级图可以给5V正极材料的筛选提供有益的理论指导[47]。
表1 各种过渡金属离子电对的氧化还原电位(金属锂为负极)
| 电对 | Mn4+/Mn5+ | Co3+/Co4+ | Fe3+/Fe4+ | Cu2+/Cu3+ | Cr3+/Cr4+ | Ni2+/Ni4+ |
| 电位/V | 5.1 | 5.0 | 4.9 | 4.9 | 4.8 | 4.7 |
随着低价态过渡金属离子(M2+或M3+)掺杂量的增加,LiMxMn2-xO4中的Mn的平均价态也逐渐增加,即Mn3+的相对量减少,从而Mn3+/ Mn4+对应的4V平台也减少,5V附近的平台则相应地增加。理论上,当Mn3+完全消失时,4V平台也就没有了,LiMxMn2-xO4的充放电曲线则表现为单一的5V附近的平台,对应的化合物为: LiCoMnO4、LiCrMnO4、LiFeMnO4、LiCu0.5Mn1.5O4、LiNi0.5Mn1.5O4。在这些尖晶石结构型化合物中,LiNi0.5Mn1.5O4的研究是最多的,它表现出最好的电化学性能。由于在Li+的嵌入和脱出过程中不存在Mn3+/Mn4+的氧化-还原,只存在Ni2+/Ni4+的氧化-还原,故不会产生Jahn-Teller畸变效应以及晶体结构变化,只有4.7V的放电平台,放电容量可达理论容量(146.7 mAhg-1)的90%以上,循环稳定性也较好[7~11]。所以LiNi0.5Mn1.5O4具有高功率、高能量密度的优点,再加上它的成本低、环境友好、安全性好等优势,使其在与常规正极材料的竞争中优势明显,并有望成为能量储备器件和动力电池的最佳正极材料之一。本文就最近几年来关于尖晶石型LiNi0.5Mn1.5O4正极材料的结构、合成及修饰改性等研究进展进行评述。
1 LiNi0.5Mn1.5O4正极材料的结构
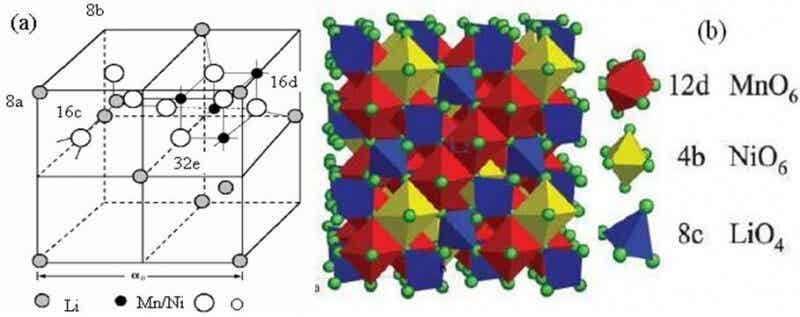
尖晶石型LiNi0.5Mn1.5O4为立方晶型,存在二个空间群结构: Fd3m和P4332结构。在Fd3m结构中,Ni无序地取代部分Mn原子,都占据16d位;而在P4332结构中,Ni有序的取代了部分Mn的原子,16d位分为4b位和12d位,Ni占据4b位,Mn占据12d位。一般认为,Fd3m结构的LiNi0.5Mn1.5O4的电化学性能要比P4332结构的好,这主要与在充放过程中锂离子的扩散路径以及电子传导率有关[12],而退火处理可以使Fd3m结构中的少量Mn3+变成Mn4+,从而转变为P4332结构。图1为尖晶石型LiNi0.5Mn1.5O4的结构示意图。
2 LiNi0.5Mn1.5O4的合成方法
正极材料的电化学性能是由它的物质组成、结构与制备工艺决定的,故选择适当的原料和制备工艺是制备具有优良电化学性能LiNi0.5Mn1.5O4正极材料的关键。目前合成LiNi0.5Mn1.5O4的主要方法有固相球磨法、共沉淀法、Sol-gel法、喷雾热解法和熔盐法等。
2.1 固相球磨法
固相反应法具有设备和工艺简单、制备条件容易控制以及易于工业化生产等优点,是目前大规模生产锂离子电池正极材料的主要方法。固相反应法制备LiNi0.5Mn1.5O4正极材料,一般是以Ni、Mn的氯化物[13,14]、氧化物[15]、硝酸盐或醋酸盐[16,17]和硝酸锂、醋酸锂或碳酸锂为起始原料,经球磨后再高温烧结,从而制备出LiNi0.5Mn1.5O4正极材料。采用固相反应法制备LiNi0.5Mn1.5O4却不容易克服比如晶粒尺寸过大、形貌不规则、晶粒尺寸分布太宽等缺点,并且当合成温度过高时,容易产生NiO或LixNi1-xO等杂相,合成单相LiNi0.5Mn1.5O4比较困难。
Chen等[17]以Ni(NO3)2•6H2O、MnO2 和Li2CO3为原料,以无水乙醇为分散介质,分别球磨和手工研磨5-12h,再将干燥后的研磨产物在750℃煅烧6-24h,得到了LiNi0.5Mn1.5O4正极材料,考察了不同的Ni源对LiNi0.5Mn1.5O4电化学性能的影响。XRD分析表明,只有当Ni源为Ni(NO3)2•6H2O时,才能够制备出不含有任何杂相的LiNi0.5Mn1.5O4,而Ni源为Ni(CH3COO)2•6H2O, NiO 或Ni2O3时,都会出现NiO杂相。而以手工研磨的前驱物制备的样品则含有更多的NiO杂相。电化学测试表明,以Ni(NO3)2•6H2O为Ni源,并以球磨的方式制备前驱物,制备的样品的首次放电容量高达145 mAhg-1,循环10次后仍高达142 mAhg-1。
SUN等[14]以MnCl2•4H2O、NiCl2•6H2O和(NH4)2C2O4•H2O为原料,采用固相法制备了LiNi0.5Mn1.5O4正极材料。结果表明:提高烧结温度或延长烧结时间可以改善晶粒的结晶度和形貌,在800℃烧结6h制备的样品的电化学性能最好,当充放电倍率为0.2C时,放电容量为136 mAhg-1,而在5C放电倍率循环30次后,容量还高达101 mAhg-1。
2.2 共沉淀法
共沉淀法是指在溶液中含有至少两种阳离子,它们均匀分布于溶液中,经沉淀反应后,可得到各种成分均一的沉淀。共沉淀法是制备锂离子电池正极材料的重要方法之一。共沉淀法制备LiNi0.5Mn1.5O4正极材料时,一般是以Ni、Mn的氯化物[18]、醋酸盐[19]、硝酸盐[20,21]、硫酸盐[22]为原料,以碳酸盐、氢氧化物、草酸等为沉淀剂,制备出沉淀后再与锂盐混合均匀,然后再煅烧制备出产物。共沉淀法工艺简单,通过改变共沉淀工艺条件能够调控最终产物的粒径分布以及形貌,能够制备出高电化学性能的LiNi0.5Mn1.5O4正极材料。但在共沉淀过程中,却难于保证各种金属离子的沉淀速率一致,不易实现各组分在分子水平上的均匀分布,而且制备出镍和锰的沉淀后,往往是再通过球磨的方式将沉淀与锂盐混合,所以也不容易实现锂盐和沉淀混合均匀。
Fang等[18]以NiCl2•6H2O、MnCl2•4H2O为原料,氨水为沉淀剂,采用共沉淀法制备了LiNi0.5Mn1.5O4正极材料。研究表明:制备的样品为单一的尖晶石结构,没有杂质成分;晶粒为八面体形貌,大约为2um;样品经300次循环后放电容量保持率为83%,表现出优越的循环性能;Li+的扩散系数在4.1V平台处为5.94×10-11 cm2 s-1,而在4.75V和4.86V处分别为4.35×10-10 cm2 s-1和7.0×10-10 cm2 s-1;退火处理过的样品在300次循环后晶格参数a减少了0.42%,而未退火处理的样品则减少了0.54%;首次证实了Ni和Mn不仅会溶解在电解液中,而且还会进一步沉积在负极表面上。
Liu等[19]以乙酸盐为原料、草酸为沉淀剂,采用共沉淀法制备了LiNi0.5Mn1.5O4正极材料。研究结果表明:900℃烧结24h制备的样品表现出优越的电化学性能。杂相LixNi1−xO的存在导致少许Mn3+存在于晶相中,故充放电曲线上有少许的4.1V的平台。当充电截止电压大于4.9V时,可能会导致电解液分解而使其性能下降。当充电截止电压为4.8V时,0.2C放电容量为130mAhg-1,并在50次循环后容量没有衰减。当放电倍率为2C和5C时,容量急剧下降,但10C循环50次后再以0.1C充放电,容量又恢复到了134mAhg-1。
2.3 Sol-gel法
Sol-gel法由于能够实现各原料组分在原子级水平上的均匀分布,故是制备锂离子电池正极材料LiNi0.5Mn1.5O4的常用方法之一[23~27]。一般来说,由于各组分均匀分布,在固相反应中各组分的扩散路径较短,故煅烧温度相对较低,煅烧的时间也相对较短,制备的产物颗粒细小,分布均匀,结晶性能好,初始容量较高,循环性能较好,但该方法工艺较复杂,成本较高,不利于实现工业化生产。
Sun等[23]以Sol-gel法合成了LiNi0.5Mn1.5O4正极材料。研究表明:相比传统合成方法,采用超声波辅助的Sol-gel法对于合成颗粒大小均一的正极材料更有效;在850℃合成的样品具有最好的电化学性能,0.2C倍率放电容量达134.5mAhg-1,50次循环后容量保持率为96.2%;当烧结温度提高时,杂相明显增加,4V放电平台也增大。
Hwang等[24]以LiCH3COO•2H2O,Mn(CH3COO)2•4H2O,Ni(CH3COO)2•4H2O为原料,柠檬酸为螯合剂,采用Sol-gel法分别在700℃,750℃,800℃和850℃制备出了尖晶石型结构Li1.02Ni0.5Mn1.5O4。研究结果表明:样品的电化学性能严重依赖样品的结晶度、颗粒大小和颗粒尺寸分布,而合适的烧结温度和烧结时间是取得适当的结晶度、颗粒大小和颗粒尺寸分布的关键。800℃和850℃合成的样品在25℃的环境温度及0.1C和0.5C的充放电倍率条件下的比容量最高,循环稳定性最好。800℃合成的样品在55℃高温条件下表现出优良的倍率性能,而850℃合成的样品的容量和循环稳定性都很差,这可能是因为在850℃合成的样品的晶粒尺寸过大以及氧缺陷过多的缘故。
2.4 喷雾法
喷雾法[28~32]制备 LiNi0.5Mn1.5O4的一般步骤是将锂、镍和锰的醋酸盐或硝酸盐等可溶性原料配成混合溶液,再用喷雾器具将溶液喷成雾状,而后再根据原料的构成配比以及温度等条件可选择干燥、热解或燃烧等方式制备出最终样品。
Li等[28]以LiOH•H2O,Ni(NO3)2•6H2O和Mn(CH3COO)2•4H2O为原料,采用喷雾干燥法制备出前驱体,然后高温煅烧制备出最终样品。研究结果表明,在氧气中退火不仅能够减少样品中Mn3+的含量,而且能够提高放电容量以及倍率特性;样品的循环性能与在循环过程中发生的晶相转变之间有极大的关系。
Park等[29]以LiNO3、Ni(NO3)2 •H2O和Mn(NO3)2•4H2O为起始原料,按Li/Ni/Mn= 1.06:0.5:1.5的摩尔配比,溶于去离子水中,再将配好的溶液加入不断搅拌的柠檬酸溶液中,并以氨水调节pH值,通过超声波喷雾形成气溶胶,气溶胶干燥后,分别在不同的温度下烧结从而制备出最终样品LiNi0.5Mn1.5O4。研究结果表明: 900℃烧结制备的样品在循环过程中没有明显的容量衰减,循环40次后容量保持率超过99%,容量还保持在135 mAhg-1以上,而750℃和800℃烧结的样品的容量在40次循环后则分别衰减到119mAhg-1和125mAhg-1。
2.5 熔盐法
熔盐法[10,33,34]一般是以氯化物等为熔盐,在一定温度下熔盐变为融熔态,成为反应介质,能极大的提高参与反应的离子的扩散速度,并在液相中实现各组分在原子水平上的均匀混合,使得反应具有一定的液相反应特征,将固-固反应转化为固-液反应。
熔盐法的优点在于操作比较简单, 但由于煅烧温度一般比较高, 能耗较大, 阻碍了其实际应用。
Kim等[10]采用熔盐法, 将LiOH、Ni(OH)2 和γ-MnOOH 以化学计量比混合均匀, 再按不同的摩尔比与LiCl 混合, 分别在700℃~1000℃范围内煅烧, 然后冷却至室温, 分别用去离子水和酒精洗涤除去残留的锂盐, 干燥后得到最终产物。研究表明:煅烧气氛必须控制恰当,过多的或过少的氧气都会造成杂相生成;与固相法相比,熔盐法更容易制备出单一的尖晶石结构;随着LiCl量的增加,产物颗粒变大,分布范围变窄;随着煅烧温度的提高和时间的延长,产物晶粒变大,产物的结晶度提高。900 ℃煅烧3 h制备的样品的初始放电容量为139mAhg-1,50次循环后容量保持率仍为99%。
Wen[34]等人采用熔盐法,首先用KMnO4和MnSO4制备出球状MnO2,按化学计量比称取LiOH、Ni(OH)2,再与过量的NaCl和KCl研磨1h,然后800℃下焙烧12h,产物用去离子水洗净残留的Na、K、Cl。研究表明:MnSO4溶液的pH值影响合成的MnO2的形貌和颗粒大小,当pH控制在0.1时,合成了表面光滑的球状颗粒MnO2。由于原料在液态的熔盐中反应,故反应物具有更高的扩散率,有利于制备出不含有任何杂质的尖晶石结构LiNi0.5Mn1.5O4;分别以商业生产的MnO2和自制的球状MnO2为起始原料制备出LiNi0.5Mn1.5O4,在室温下以1C的放电倍率进行充放电,其首次充放电容量分别为125mAhg-1和120mAhg-1、135mAhg-1和129mAhg-1,循环50次后的容量保持率分别为90.1%和98.6%。
3 LiNi0.5Mn1.5O4 的掺杂和表面包覆
3.1 LiNi0.5Mn1.5O4的掺杂
掺杂主要是用Fe、Cu、Cr、Co等活性金属离子[35~38]或者Ti、Mg、A1等非活性金属离子[39-40]取代部分Ni、Mn,用S、F等阴离子[9, 30]取代部分的O,以起到提高材料的放电容量和循环性能并改善充放电平台的单一性等方面的作用。
Aklalouch等[35]以蔗糖辅助燃烧法合成了LiCr2YNi0.5−YMn1.5−YO4 (0<Y≤0.2)。研究表明:Cr3+无序地取代Ni2+和Mn3+的位置;煅烧温度对最终样品的结构和成分并没有较大的影响;晶粒大小依赖于煅烧温度而不是掺Cr3+量;合成条件对材料样品的放电容量(约130mAhg-1)的影响不明显,但对其循环性能的影响较大;900℃合成的掺杂样品正极材料LiCr2YNi0.5−YMn1.5−YO4 (Y< 0.1),在50℃下循环时,其首次放电容量高达140 mAhg-1, 40次循环后容量保持率仍为96%。
Park等[36]研究了不同的掺Cr量对LiNi0.5Mn1.5O4电化学性能的影响。研究表明:随着掺Cr量的增加,LiNi0.5Mn1.5O4的首次放电容量和循环稳定性都得到了改善。作者认为这是因为Cr与O的结合能比Ni和O的高,可以减少高温煅烧时的氧缺失,并提高了结构的稳定性;掺Cr能够降低Mn3+的含量,减少了4V平台,从而增加了5V的放电平台和容量,没有掺杂的 LiNi0.5Mn1.5O4的首次放电容量是128.67 mAhg−1,50次循环后容量保持率为92℅,而LiNi0.5−xMn1.5CrxO4 (x = 0.05)的首次放电容量和50次循环后的容量保持率分别提高到137mAhg−1 和97.5%。
Lafont等[39]采用固相法合成了LiMg0.05Ni0.45Mn1.5O4。研究结果表明,样品的C/10倍率放电容量为131 mAhg-1,5C倍率放电容量为90 mAhg-1。室温下样品材料的电导率为10-6Scm-1,Mg2+掺杂有助于保持结构在高倍率充放电中的稳定性。
3.2 LiNi0.5Mn1.5O4的表面包覆
LiNi0.5Mn1.5O4具有高达4.7V的充放电平台,极易引起电解液的氧化还原反应,必然降低锂离子电池的电化学性能,而表面包覆可以避免或减少正极材料与电解液的直接接触,从而减少电解液的分解。目前,主要的包覆物有ZnO[41, 42]、ZrO2[43] 、SiO2[44]、Bi2O3[45] 、BiOF[46]等。
Wu等人[43]分别以ZrO2和ZrP2O7包覆LiNi0.5Mn1.5O4。研究结果表明:以ZrO2包覆的样品显著地提高了循环稳定性,在55℃下循环150次后容量保持率为96%,而没有包覆的样品和以ZrP2O7包覆的样品容量保持率却分别只有73%和80%。DSC分析也表明包覆能显著提高样品的热稳定性。ZrO2包覆的样品表现出的优越的电化学性能可能是因为致密、大小均一纳米氧化锆微粒有效地阻止了正极材料与电解液的反应,抑制了电解液反应活性的降低,也就抑制了正极与电解液的界面电阻的增加,从而提高了循环稳定性。
Kang等人[46]研究了BiOF包覆LiNi0.5Mn1.5O4在55℃的电化学性能。研究结果表明:BiOF包覆层的厚度为10nm,该包覆层能够防止HF对正极材料的侵蚀,也能抑制Ni和Mn溶解于电解液中,所以表面包覆BiOF能极大提高正极材料的循环稳定性。BiOF包覆的样品在55℃下循环70次后容量保持率为84.5%,而未包覆的样品保持率则仅为31.3%。可见包覆的效果是很明显的。
4 结语
LiNi0.5Mn1.5O4 正极材料具有唯一并高达4.7V的充放电平台等优点,有望成为能量储备器件和动力电池的最佳正极材料之一。从近几年已发表的文献来看,LiNi0.5Mn1.5O4正极材料的研究从2006年开始进入快速发展阶段,LiNi0.5Mn1.5O4 正极材料的合成、改性和商品化应用研究已取得了较大的进展,许多方法都能够制备出电化学性能优异的LiNi0.5Mn1.5O4正极材料。随着5V正极材料的耐高电压电解液问题的基本解决,目前困绕LiNi0.5Mn1.5O4的发展则主要是如何低成本大规模生产的问题,这还需要广大科研工作者共同努力,继续寻找一种操作简便、成本低廉、环境友好的大规模生产方法,并进一步提高LiNi0.5Mn1.5O4 正极材料的电化学性能。
参考文献
[1] M. Armand, J.-M. Tarascon. Researchers must find a sustainable way of providing the power our modern lifestyles demand [J]. Building better batteries, Nature, 2008, 451: 652–657
[2] J. Hassoun, P. Reale, B. Scrosati. Recent advances in liquid and polymer lithium-ion batteries [J]. J. Mater. Chem., 2007, 17: 3668–3677
[3] A.K. Shukla, T.P. Kumar. Materials for next-generation lithium batteries [J]. Curr. Sci., 2008, 94: 314–331
[4] Jeffrey W. Fergus. Recent developments in cathode materials for lithium ion batteries [J]. Journal of Power Sources, 2010, 195: 939–954
[5] D.H. Jang,Y.J. Shin, S.M. Oh. Dissolution of spinel oxides and capacity losses in 4V Li/LixMn2O4 cells [J]. J. Electrochem. Soc., 1996, 143: 2204–2211
[6] Y. Xia, Y. Zhou, M. Yoshio. Capacity Fading on Cycling of 4 V Li/LiMn2O4 Cells [J]. J. Electrochem. Soc., 1997, 144: 2593–2600
[7] M. Kunduraci, J.F. Al-Sharab, G.G. Amatucci. High-Power Nanostructured LiMn2-xNixO4 High-Voltage Lithium-Ion Battery Electrode Materials: Electrochemical Impact of Electronic Conductivity and Morphology [J]. Chem. Mater., 2006, 18: 3585–3592
[8] H.Y. Xu, S. Xie, N. Ding, et al. Improvement of electrochemical properties of LiNi0.5Mn1.5O4 spinel prepared by radiated polymer gel method [J]. Electrochimica Acta 51 (2006) 4352–4357.
[9] X.X. Xu, J. Yang, Y.Q. Wang, et al. LiNi0.5Mn1.5O3.975F0.05 as novel 5 V cathode material [J]. Journal of Power Sources 174 (2007) 1113–1116.
[10] J.-H. Kim, S.-T. Myung, Y.-K. Sun. Molten salt synthesis of LiNi0.5Mn1.5O4 spinel for 5 V class cathode material of Li-ion secondary battery [J]. Electrochimica Acta 49 (2004) 219–227.
[11] Yanyan Sun, Yifu Yang, Hui Zhan. Synthesis of high power type LiMn1.5Ni0.5O4 by optimizing its preparation conditions [J]. Journal of Power Sources 195(2010) 4322–4326.
[12] Kim J H, Yooh C S ,Myung S T. Phase transitions in Li1-δNi0.5Mn1.5O4 during cycling at 5V [J]. Electrochem Solid-State Lett. 2004,7(7):A216-A220.
[13] Haisheng Fang, Liping Li, Guangshe Li. A low-temperature reaction route to high rate and high
(陈炳,蔡宇,王震伟,刘珊珊,谭铭,熊伟强,张真,刘兴泉)
(电子科技大学微电子与固体电子学院,四川成都,610054)
(电子薄膜与集成器件国家重点实验室,四川成都,610054)
(电子科技大学新能源材料与集成能源器件研发中心,四川成都,610054)


