摩尔比对锂离子电池正极材料α-LiFeO2的性能影响
1 前言
胡友作1,赵红远1,谭铭1,刘珊珊1,刘兴泉1,2*
1、电子科技大学微电子与固体电子学院新能源材料与器件实验室 四川成都 610054
2、四川富骅新能源科技有限公司 四川绵阳 621006
摘要:层状正极材料LiFeO2理论比容量较高,原材料来源丰富,无毒无污染,是极具商业前景的锂离子电池正极材料。本文通过液相法在室温下将锂盐和铁盐于乙醇溶液中反应得到α-LiFeO2,通过研究不同Li+/Fe3+摩尔比对材料电化学性能的影响,结果发现Li+/Fe3+摩尔比为8.75时得到的材料具有最佳的电化学性能。
Effect of different Li+/Fe3+ molar ratios on the performance of α-LiFeO2 served as cathode material of lithium ion batteries
HU You-zuo1, ZHAO Hong-yuan1, TAN Ming1, LIU Shan-shan1, LIU Xing-quan1,2*
1 R&D Center for New Energy Materials and Devices, School of Microelectronics and Solid State Electronics, University of Electronic Science and Technology of China, Chengdu 610041, Sichuan China
2 Sichuan Fuhua New Energy High-Tech Co., Ltd. Mianyang 621006, Sichuan China
Abstract:Layered LiFeO2 is a kind of very attractive lithium ion battery cathode material for the high theoretical capacity, natural abundance and environmental benignity. In this paper, α-LiFeO2 was synthesized by liquid phase in absolute ethanol solution, the influence of Li+/Fe3+molar ratios on the electrochemical activity was discussed, the results showed that the electrochemical performance is the best when the optimal molar ratio is 8.75.
Key Words:lithium ion batteries;cathode material;α-LiFeO2; Li+/Fe3+ molar ratio
1 引言
随着社会的高速发展,科技的不断进步,能源供给,环境保护,经济增长三者之间的平衡关系正在被高度重视。目前,传统能源仍然是各国的主要供给能源,这些能源的高能耗,高污染和不可再生性严重污染环境破坏生态的同时,也引起了严重的能源短缺危机。传统能源已不能满足社会经济发展的需求和可持续发展的战略理念。因此,绿色环保,可持续的新能源在被发现以来不断受到关注,并已经成功应用于生产和生活中[1]。体积小,重量轻,容量大,功率高和环境友好的锂离子电池自1991年被Goodenough等人发现以来,就受到极大关注,同时也因其高比容量,高稳定性,和低成本被广泛应用于手机,电脑等可移动电子设备,航空航天和汽车等重工行业也开发出了相应的大容量锂离子电池[1]。
目前,已商业化的锂离子电池正极材料中,LiCoO2,LiNiO2和LiMnO2三种层状过渡金属氧化物正极材料占据了较大的市场份额。其中,LiCoO2作为最早实现商业化的电池,其理论容量为273 mAh/g,对其研究也较成熟,但是其成本较高,毒性较大。LiNiO2与LiCoO2具有相同的结构和理论容量,在应用过程中容易与电解液结合,导致电池循环稳定性较差。LiMnO2理论容量较高,但在充放电过程中会发生姜泰勒效应,导致容量急剧衰减,从而使其商业运用受到阻碍[1]。同样是层状过渡金属氧化物的LiFeO2,不仅理论容量较高,原材料及其丰富,且无毒环保,是极具优势的锂离子电池正极材料。Sakurai等[2]人分别在室温和低于250℃的条件下通过离子交换法制备出了具有电化学活性的波纹层状和针铁矿型LiFeO2。Lee等[3]人在150℃下通过传统固相法合成了正交相LiFeO2,其初始放电比容量达到150 mAh/g。Xiong Wang等[4]人以β-FeOOH为前驱物通过低温熔盐法得到纳米棒状α-LiFeO2,与块状材料相比其性能明显提升。可见,低温合成的LiFeO2具有较好的电化学活性。本文通过低温合成法制得了电化学性能较好的α-LiFeO2,并探讨了不同Li+/Fe3+摩尔比下所得样品的电化学性能。
2 实验
分别以Fe(NO)3•9H2O和LiOH•H2O为铁源和锂源,按不同的Li+/Fe3+摩尔比称取一定量的Fe(NO)3•9H2O和LiOH•H2O,溶于无水乙醇中,室温下磁力搅拌4小时,得到的红棕色沉淀经无水乙醇和去离子水反复离心洗涤除去多余的原料,最后抽滤置于100℃烘箱中20h,得到最终产物α-LiFeO2。分别测量产物的扫描电镜显微镜(SEM),X-射线衍射仪(XRD)。以85:10:5的比例称取一定量的正极材料,乙炔黑和PVDF制备成正极片,制成扣式电池后在0.1C倍率下,1.5~4.8V电压区间进行电化学性能测试,用Land电池测试系统对产物电化学性能进行测试。
3 结果与讨论
分别以Fe(NO)3.9H2O和LiOH.H20为锂源和铁源,按Li+/Fe3+摩尔比为1,5,8.75和10在室温下得到最终产物LiFeO2。如图1所示不同Li+/Fe3+摩尔比所得四组样品的SEM图谱,由图可知随着Li+/Fe3+摩尔比不断增大,所得样品的颗粒逐渐减小且更均匀,到Li+/Fe3+为10时颗粒变大,粒径大小不一。其中Li+/Fe3+为5和8.75时样品颗粒粒度小,分散性较好。

(a)Li+/Fe3+=1,(b)Li+/Fe3+=5,(c)Li+/Fe3+=8.75, (d)Li+/Fe3+=10
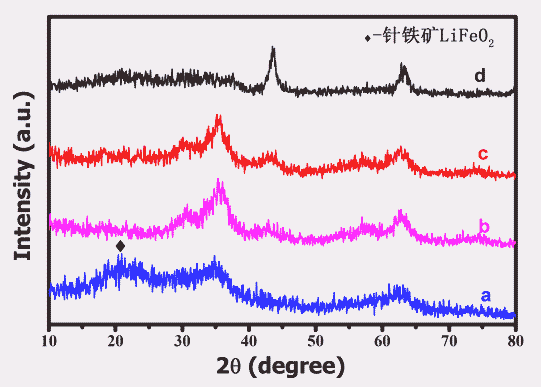
由图2的XRD图谱可以发现Li+/Fe3+摩尔比为1时α-LiFeO2的特征峰未明显出现,Sakurai等[5]人认为在Li+/Fe3+比为1时有针铁矿LiFeO2和α-LiFeO2同时生成,由图也可发现在2θ=20°时有隶属于Pnma空间群的针铁矿LiFeO2的特征峰出现,Li+/Fe3+摩尔比增加后针铁矿特征峰消失,Li+/Fe3+>1时所有样品的XRD图谱均与α-LiFeO2对应,Li+/Fe3+比增大到10时α-LiFeO2位于2θ=35°的特征峰消失,而其余峰位得到加强,可见不同Li+/Fe3+摩尔比对生成的LiFeO2有较大影响。
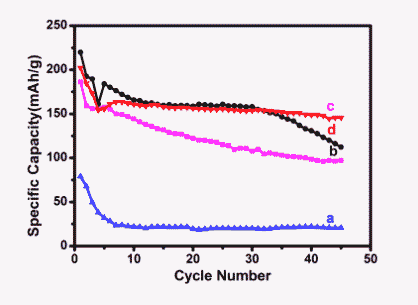
图3为0.1C倍率下,1.5V~4.8V电压区间内不同Li+/Fe3+摩尔比下得到的样品的循环稳定性,Li+/Fe3+为1时放电比容量较低,循环到第五次后比容量维持在25 mAh/g左右直至结束。Li+/Fe3+为5时,初始放电比容量为185mAh/g,循环到45圈后容量保留率为52%。Li+/Fe3+为8.75时初始放电比容量达到219 mAh/g,循环到45圈后为143 mAh/g,容量保留率为65%。Li+/Fe3+为10时,循环45圈后比容量为127 mAh/g,容量保留率为51%。综上可以发现,常温下合成LiFeO2的电化学性能受Li+/Fe3+摩尔比影响较大,随着Li+/Fe3+摩尔比的增加电化学性能不断改善,到两者摩尔比为8.75时电化学性能最佳。Li+/Fe3+为10时初始放电比容量增加,但循环稳定性下降。
(a)Li+/Fe3+=1,(b)Li+/Fe3+=5,(c)Li+/Fe3+=8.75,(d)Li+/Fe3+=10
(a)Li+/Fe3+=1,(b)Li+/Fe3+=5,(c)Li+/Fe3+=8.75,(d)Li+/Fe3+=10
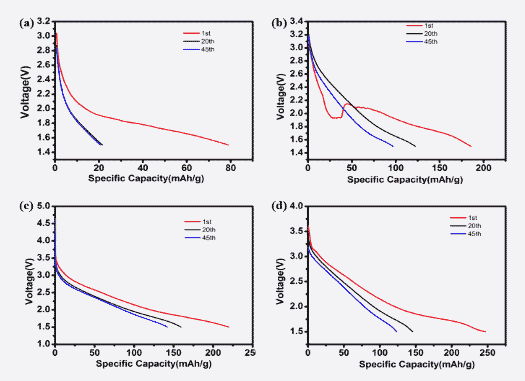
图4为不同Li+/Fe3+下电池循环至第1、20和45圈时放电比容量。从图中可以发现不同Li+/Fe3+为1时首次放电电压平台位于1.8V-2.0V之间,第20圈和45圈的放电电压平台位于1.5V-1.8V,可见首次放电电压平台与后续电压平台明显不同,这或许是混入针铁矿LiFeO2的缘故。由图(b)、(c)、(d)可以发现Li+/Fe3+为5、8.75和10时首次放电电压平台与后续电压平台一致,且都集中于1.5V-2.0V之间。其中(c)图中Li+/Fe3+比为8.75时首圈放电比容量与后续放电比容量接近,从(a)、(c)、(d)中的特征放电曲线可以发现Li+/Fe3+比为1时容量衰减迅速,Li+/Fe3+为5和10时从首圈到第20圈容量有大幅衰减,第20圈至第45圈衰减逐渐缓慢,但比容量与稳定性与(c)中Li+/Fe3+比为8.375时的样品相比较差。
(a)Li+/Fe3+=1,(b)Li+/Fe3+=5,(c)Li+/Fe3+=8.75,(d)Li+/Fe3+=10
4 结论
本文通过改变Li+/Fe3+摩尔比在室温下乙醇溶液中制得α-LiFeO2,在Li+/Fe3+摩尔比为1、5、8.75和10时分别对所得样品进行形貌和成分的表征,发现随着Li+/Fe3+摩尔比增加样品颗粒粒径不断减小,粒度更均匀,到Li+/Fe3+摩尔比为8.75时样品形貌最佳,之后继续提高Li+/Fe3+摩尔比形貌变差。同时发现Li+/Fe3+摩尔比为1时有针铁矿LiFeO2生成,Li+/Fe3+摩尔比为10时α-LiFeO2有些特征谱峰消失。对不同摩尔比的四个样品进行电化学性能测试发现Li+/Fe3+摩尔比为8.75的初始放电比容量达到219 mAh/g,循环到45圈容量保留率为65%,电池循环稳定性和比容量优于其他三个样品。可见Li+/Fe3+摩尔比对α-LiFeO2的电化学性能有较大影响,并发现最优的Li+/Fe3+摩尔比为8.75。
参考文献
[1]M. Stanley Whittingham.Lithium Batteries and Cathode Materials [J].Chem. Rev. 2004, 104: 4271 – 4301.
[2]Yoji Sakurai , Hajime Arai, Shigeto Okada, et al. Low temperature synthesis and electrochemical characteristics of LiFeO2 cathodes[J]. Journal of Power Sources.1997, 68:711-715.
[3]Yun Sung Lee, Chong Seung Yoon, et al. Synthesis of nano-crystalline LiFeO2 material with advanced battery performance [J].Electrochemistry Communications 2002,(4):727–731.
[4]Xiong Wang, Lisheng Gao, et al. Large-scale synthesis of a-LiFeO2 nanorods by low-temperature molten salt synthesis (MSS)method [J].Journal of Crystal Growth.2004,265 :220–223.
[5]Yoji Sakurai, Hajime Arai, Jun-ichi Yamaki. Preparation of electrochemically active a-LiFeO2 at low Temperature[J]. Solid State Ionics, 1998,29–34.


