橄榄石型锂离子电池正极材料磷酸铁锂和磷酸锰锂的研究进展
1 前言
锂电世界讯,自J.B.Goodenough [1] 等人于1997年首次报道了化合物LiMPO4 (M = Mn, Fe)可作为锂离子电池正极材料以来,对该类化合物的研究就一直未能停止。该类化合物具有合成原材料丰富、生产成本低、无毒、环保、结构稳定、热稳定性好、常温电化学性能优良等特点,因而获得了迅速发展,目前已经进入商业化生产。但是,因为LiMPO4 (M = Mn, Fe)材料自身离子电导率和电子电导率低,因此造成LiMPO4 (M = Mn, Fe)材料放电倍率性能很差,而且循环性能不佳。同时由于LiFePO4的嵌脱锂电位较低,因而导致LiFePO4充放电电压平台较低,仅为3.4V(vs Li/Li+),其理论放电比容量为170mAh/g。但是在低温下放电比容量更低,实际比容量最高只能达到110mAh/g。LiMnPO4的嵌脱锂电位较高,因而其充放电电压平台较高,充放电平台电压为4.1V(vs Li/Li+),但是其离子电导率更低,因而放电比容量也低,而且电压电势下降很快。后续研究发现在固相法生产LiMPO4类材料过程中,存在着材料的振实密度较低,批次的一致性差等问题。针对该材料特点,许多学者对其进行了多方面的改性研究。
2 LiFePO4的改性研究
2.1 前驱体优化及金属元素掺杂改性
Hong-Qiang[2]等以非离子型表面活性剂(吐温40)作为添加剂,葡萄糖作为碳源,前驱体中加入添加剂,干燥后 N2保护下加热煅烧(三个煅烧温度研究点:680,720,750℃),合成得到实验样品。
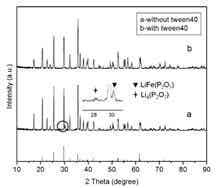
对比分析XRD图谱,a曲线多出2个微小的寄生峰,两个曲线其余峰形一致,峰形显示表面活性剂并不影响LiFePO4晶体的形成,但是阻止了合成转化过程中中间产物的产生。该寄生峰推论为LiFePO4在高温转化过程中的中间产物焦磷酸锂(Li4P2O7)和焦磷酸铁锂(LiFeP2O7)的物相。

SEM图谱分析表明:(1)随着煅烧温度的升高,晶体颗粒尺寸增大,团聚现象增加;(2)在同样温度下,含有表面活性剂样品的晶体颗粒尺寸小于无活性剂样品的晶体颗粒尺寸,且颗粒团聚度呈现同样的变化规律,如表1所示。
表1 两种样品的粒子特性数据
| 样品性质 | 有吐温40样品 | 无吐温40样品 | ||||
|---|---|---|---|---|---|---|
| 680℃ | 720℃ | 750℃ | 680℃ | 720℃ | 750℃ | |
| 平均晶体尺寸(nm) | 31 | 34 | 38 | 36 | 44 | 54 |
| 粒径范围 (nm) | 60-100 | 60-150 | 80-200 | 100-280 | 120-350 | 120-800 |
| 平均粒子尺寸(nm) | 70 | 110 | 160 | 180 | 300 | 500 |
| C含量(wt%) | 1.5 | 1.5 | 1.4 | 1.5 | 1.5 | 1.5 |
前驱体添加活性剂后合成的正极材料粒子特性良好,电化学性能测试数据优异(见表2),更能满足锂离子电池对于材料的要求。性能改善的原因:活性剂在高温热解中有助于C包覆层均匀,促使样品材料颗粒尺寸一致性较好,团聚度减小,提升材料的电化学性能。
表2 两种样品不同倍率下的电化学容量以及低温(-20℃)电化学容量
| 样品类型 | 0.1C | 0.5C | 1C | 5C | 0.1C(-20℃) |
|---|---|---|---|---|---|
| 有吐温40 | 163.6mAh/g | 156.8mAh/g | 142.7mAh/g | 121.6mAh/g | 131.3mAh/g |
| 无吐温40 | 137.5mAh/g | 126.3mAh/g | 110.2mAh/g | 96.6mAh/g | <40mAh/g |
ZHAO Nannan[3]等采用固相法合成了铈离子(Ce3+)掺杂的LiFePO4/C正极材料,并对样品进行理化分析和电化学性能测试。
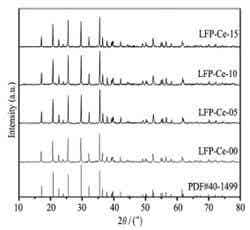
样品的XRD图谱如图3所示,从XRD图谱可以看出,掺杂铈离子并没有在XRD的峰形中出现杂峰,表明掺杂金属元素并不影响LiFePO4/C晶体的形成,而是完全进入了LiFePO4/C的晶格中。
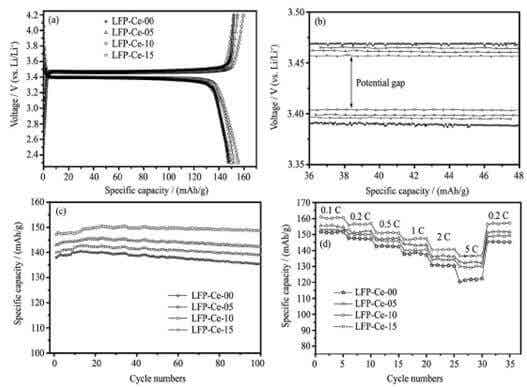
样品电化学性能测试数据见图4,从图谱数据得知掺杂修饰后的材料电化学性能明显优于未掺杂样品的电化学性能。研究得出掺杂金属离子提高材料的电子传导率,提升了锂离子的扩散通道,从而整体提高了材料的电化学性能。
倪江锋[4]等用机械球磨和共沉淀两种方法合成Cr3+掺杂的LiFePO4材料,并对合成后的化合物进行了XRD,SEM等理化表征和电化学性能测试。对比纯LiFePO4,掺杂后的LiFePO4化合物电化学性能得到很大的改善,充放电比容量可达到144mAh/g和158mAh/g,大于未掺杂的纯LiFePO4。
钟美娥[5]等加入Mn盐对化合物LiFePO4进行掺杂,对掺杂后的样品进行了理化特征分析和电化学性能测试,测试结果发现碳包覆和少量 Mn2+一起掺杂的样品,可以有效地提高 LiFePO4材料的电子电导率和锂离子扩散速率,从而提高了充放电容量。许多研究者[6-13]都对Mn离子掺杂LiFePO4材料的影响和电化学性能进行了研究。
Qiao-Ying Huang[14]等采用固相法合成了以下系列化合物:LiMnPO4/C、LiMn0.85Fe0.15PO4/C以及LiMn0.92Ti0.08PO4/C和Fe、Ti联合掺杂化合物:Li(Mn0.85Fe0.15)0.92Ti0.08PO4/C,应用XRD和SEM等对样品理化特征进行了分析。XRD研究表明Ti离子和Fe离子与LMP形成了固溶体。由于Ti、Fe离子的离子半径小于Mn离子半径,所以掺杂金属元素能减小合成样品的粒子半径,有利于锂离子的扩散,尤其当Ti-Fe联合掺杂时,粒子半径变化更明显,电化学性能测试数据如图5所示。
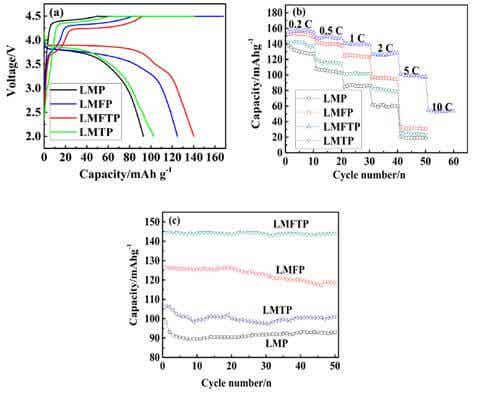
结合充放电曲线、倍率性能曲线和循环性能数据,从图5中不难看出采用Fe-Ti联合掺杂的化合物电化学性能得到较大改善,电容量、倍率特性和循环性能都有大幅度提高。
庄大高等[15]研究了水热法合成LiFePO4化合物,并采用快速冷却工艺合成,并对合成后的化合物的电化学性能进行了测试。同时研究了Mn、Ni、Co三种金属元素掺杂的LiFePO4/C化合物,通过进行样品的结构表征和电化学测试,研究了金属元素的最佳掺杂量。结果显示Co掺杂未能明显提高实验样品的电化学性能;Ni掺杂能明显提高实验样品的电化学循环稳定性:1C倍率条件下放电比容量为130 mAh/g,充放电循环100次后,容量没有减少;Mn掺杂能改善实验样品的比容量性能。研究了在水热法前驱体中掺杂Nb5+离子,并高温固相合成样品,样品进行电化学性能测试,含Nb5+ 1.0%(mol)的掺杂化合物样品在0.1C倍率时,电容量148 mAh/g,2C倍率时,电化学比容量能达到132 mAh/g。结果表明:部分掺杂少量的金属元素能改善样品的电化学性能。
SUN Yu-Heng[16]等采用固相法合成Ti掺杂LiFe0.95Ti0.05PO4的化合物,并用XRD、FTIR、SEM等对样品进行理化表征和电化学性能测试, 在1C倍率下循环20次后,样品容量能保持69%,而未掺杂化合物仅能保持33.6%,测试结果显示掺杂后的样品电化学循环稳定性更好,充放电比容量明显提升。
LianLiang Wang[17]等合成了Ag掺杂的LiFePO4/C化合物,前驱体合成中,Ag(NH3)2OH和葡萄糖溶于溶液成混合溶液参与反应。样品测试结果显示Ag粒子成功嵌入LiFePO4/C中形成固溶体,并影响样品晶体颗粒形态。电化学性能测试显示,样品的容量可以达到141.3 mAh/g,在1C倍率时循环800次容量几乎不衰减,表明Ag掺杂的化合物具有优异的充放电循环性能。
2.2合成方法改性
Kwang Joo Kim[18]、K. Rajammal[19]等采用溶胶凝胶法,以醋酸盐为原料,先合成凝胶前驱体,前驱体再经过700℃、6h的热处理,得到化合物样品。
样品A:LiCoxMn2-xO4 ( x = 0.1, 0.3 ),XRD测试表明,Co掺杂和纯LiMn2O4的晶体结构相同,表明:Co和Mn形成完全固溶体LiCoxMn2-xO4。SEM显示:溶胶凝胶法合成的样品颗粒的粒径分布范围窄,颗粒尺寸大小一致,粒子形态均一性好。两种掺杂化合物LiCo0.1Mn1.9O4、LiCo0.3Mn1.7O4与LiMn2O4材料相比,经过100次以上的充放电循环后,含Co掺杂化合物电池的电化学循环性能良好。
样品B:LiMn1-xAl0.5xCu0.5xPO4 ( x = 0.0、 0.1,、0.2),XRD测试表明,Al、Cu掺杂金属离子不改变原化合物晶体结构,但掺杂金属粒子引起原化合物的粒子半径大小变动,与纯LiMnPO4的XRD谱图对比发现,相应的衍射峰位移变化。SEM和TEM测试显示,Al、Cu掺杂的化合物(X = 0.1时)粒子尺寸最小,碳包覆均匀。电化学性能测试表明,联合掺杂化合物(X = 0.1时)的电化学特性最好。K. Rajammal[19]等分析认为Al离子的存在能提高电子迁移速率,减弱姜-泰勒效应;Cu离子能稳定晶体结构,两种金属离子联合掺杂效应能提高电子传导率并能降低电子移动的电阻。
J. Chen等[20]采用水热法合成了系列正极材料:LiFePO4/C、LiMnPO4/C、LiFexMn1-xPO4/C、LiFexNi1-xPO4/C等样品,对样品的理化特征和电化学性质进行表征和测试,结果表明:两种金属掺杂形成的化合物粒子形态一致性较好,C包覆更均匀,电化学性能更加优异。ZHOU Min等[21]也用水热法合成LiFePO4化合物,并对样品的理化特征和电化学性能进行测试,测试数据显示样品密度可以超出1.4 g/cm3,比容量能达到150 mAh/g(0.5C倍率时)。水热法具有合成简单,合成费用低,同时测试表明采用该方法合成锂离子电池正极材料是可行的。
Arun Kumar[22]等采用固相法合成纯LiFePO4和LiFePO4/C两种化合物,并对两种化合物的结构和电化学特性进行对比研究。研究发现C包覆能有效的控制LiFePO4粒子尺寸大小,能帮助Fe2+/Fe3+之间氧化还原的电子转移,电化学特性研究发现纯LFP样品循环25次容量下降31%,LiFePO4/C样品循环50次后容量下降仅3%,两份样品在C/5、 C/3和 C/2倍率时,对应的容量分别为63、43、13mAh/g和163、144、118mAh/g,从数据看出,C包覆大幅度提升了材料的电化学性能。
Z. Xu[23]等采用微乳液合成方法合成了LiFePO4/C正极材料,并对其理化特征和电化学性能进行了测试。TEM测试显示颗粒形态基本一致,颗粒团聚程度较小,C包覆均匀,厚度基本一致。电化学测试结果表明微乳液法合成的材料具有优异的充放电容量和循环性能。研究认为这些性能得到提升的原因是因为微乳液法在合成过程中更好的控制了颗粒的增长速度和颗粒形态变化,阻止了颗粒的团聚,并有利于C均匀包覆在颗粒表面,从而改善了颗粒的导电性和电化学性能。
H.-C. Kang[24]等用球磨法合成了LiFePO4/C,并对合成样品进行了分析和测试,研究了固相反应的最佳合成条件,通过样品的合成和测试寻找最佳的球磨法反应条件。
Bang-Kun Zou[25]等人以抗坏血酸作为碳源,LiOH,Mn、Fe的硫酸盐作为原料,H3PO4、乙二醇和去离子水混合溶液作溶剂,用溶剂热法合成的LiMn0.4Fe0.6PO4前驱体,前驱体经180℃干燥10 h,分作两份,分别加入0%和8%(重量比例)的葡萄糖作为联合碳源,以固相法合成得到纳米级颗粒的样品,分别命名为D0-LMFP(含0%的葡萄糖)和D8-LMFP(含8%的葡萄糖)。再以相同步骤合成两份不含抗坏血酸的样品,分别为S0-LMFP(含0%的葡萄糖)和S8-LMFP(含8%的葡萄糖)。四种样品用XRD、SEM、TEM测试,测试结果表明: D8-LMFP样品颗粒尺寸数据分布最窄,粒子形态一致性最好,团聚度小,碳包覆厚度均匀度最好。
电化学性能测试结果见表3,数据显示:D8-LMFP(即抗坏血酸和葡萄糖同时作为碳源)的化合物相对于其他三种化合物具有更优良的电容量性能和倍率特性,并且在-20℃时还能具有122.0 mAh/g的比容量,当温度恢复到25℃时,电容量同时升到常温时的容量。
表3 D8-LMFP和S8-LMFP的不同倍率下比容量数据(单位:mAh/g)
| 样品\倍率 | 0.5C | 1C | 2C | 5C | 10C | 15C | 20C |
|---|---|---|---|---|---|---|---|
| D8-LMFP | 156.8 | 155.8 | 154.0 | 150.5 | 145.1 | 140.1 | 128.5 |
| S8-LMFP | 143.1 | 141.3 | 137.6 | 133.1 | 124.7 | 117.6 | 109.2 |
J. D. Wilcox[26]等研究了影响LiFePO4/C颗粒C包覆的因素。并对影响因素进行分析和总结,通过系列实验获取颗粒粒子C包覆的最佳条件。Y.-H. Huang[27]等用聚吡咯作为碳源,进行C包覆,并对包覆后的样品进行结构表征和电化学性能测试,实验结果显示聚吡咯作为碳源,对化合物的电化学性能有较好的改善作用。
Kaipeng Wu[28]等采用绿色合成法:氧化还原-共沉淀的方法合成 (MnFe2O4/rGO)纳米粒子前驱体,前驱体经球磨,热处理后得到锂离子电池正极复合材料LiMn1/3Fe2/3PO4/rGO/C,测试结果显示:合成样品的颗粒尺寸约在200nm左右,Fe-Mn完全形成固溶体 LiMn1/3Fe2/3PO4,并且在颗粒中分布均匀,石墨烯和包覆碳组成的包覆结构在颗粒表面包覆均匀。电化学测试样品在20C倍率时具有94.8 mAh/g的放电比容量,充放电循环900次以后,容量仅下降6.25%,表明此复合材料具有优异的高倍率充放电容量和循环性能。
2.3其他改性研究
桑俊利[29]等对LiFePO4/C化合物的合成方法的改性进行了系统对比,列举了高温固相反应法、溶胶-凝胶法、微波合成法、水热合成法和共沉淀法的合成研究和优缺点;说明了LiFePO4/C材料的分析手段和电化学的测试方法,比如:红外光谱、扫描电镜、X射线衍射和电化学性能研究等。
R.V. Apraksin[30]等研究正极材料LiFe0.4Mn0.6PO4与电极粘合剂的关系,用粘合剂(PEDOT : PSS / CMC)与传统的粘合剂(PVDF)分别制作复合电极C-LFMP/PEDOT : PSS / CMC和C-LFMP/PVDF,实验发现采用新型粘合剂制作成的电极的电化学性能优于传统粘合剂制作的电极,实验数据表明:0.2C和5C倍率的放电比容量140 mAh/g、130mAh/g,高于后者电极对应的放电容量:119 mAh/g、106 mAh/g。新型粘合剂是水溶剂型粘合剂,不仅能提升该正极材料的电化学性能;相比传统粘合剂,还具有环保优势。因此,水溶剂型粘合剂是未来值得进行改性研究的方向之一。
3 LiMnPO4的改性研究
Ye Hong[31]等通过改变原材料的添加次序、改变原材料比例的方式,用可控的合成方法合成了8份LiMnPO4样品,并对样品的理化特性、晶体常数和电化学性能进行测试。测试表明:当LiOH/H3PO4 的摩尔比为2.7或3.0,采用Mn-P-Li的原材料添加次序,合成出的化合物具有最好的电化学性能,10C倍率时容量为105 mAh/g,0.5C倍率下循环100次后的容量保持率可达93%。研究还发现,当LiOH过量的情况下,有利于样品粒子尺寸的减小并能提升LiMnPO4的电化学性能。
寇立琴[32]等利用溶剂热法合成LiMnPO4/C,在合成过程中用Sr2+离子掺杂得到LiMn1-xSrxPO4/C(x = 0、0.01、 0.03,、0.05)系列化合物样品,样品的理化特征,颗粒形貌用XRD、SEM、EIS等进行分析。电化学性能测试显示,当x = 0.01时,样品的电化学性能最好:0.1C倍率充放电循环50次后电容量能达到119.2 mA•h/g,循环保持率分别为 95.5%,相应地未掺杂样品的循环保持率为85.1%。研究认为锶离子掺杂稳定了材料的晶体结构,因此改善了电化学性能。
王永强[33]等利用水热法,可控的合成了系列磷酸锰锂微纳米材料样品(LiMnPO4),根据样品的理化特性和电化学性能测试数据,获得了最优的水热法合成磷酸锰锂(LiMnPO4)的合成工艺。并且研究发现Fe元素掺杂形成的固溶体,电化学性能提升更加明显,结合水热法合成的优点,有望在磷酸锰锂(LiMnPO4)的制备研究中得到应用。
常晓燕[34]等采用固相法合成磷酸锰锂材料样品(LiMnPO4/C),主要研究合成温度和球磨时间对产物制备的影响。研究发现中间产物和反应物的混合程度,烧结温度的高低,都可以影响到磷酸锰锂材料(LiMnPO4/C)的电化学性能。
朱彦荣[35]等采用计算方法研究了锂离子电池正极材料LiMnPO4的电子结构,计算了该材料晶体的晶体结构,并且阐述了在电化学反应过程中,晶体内电子转移和相应地结构变化情况。
杨新[36]等采用固相法合成了LiMnPO4/ C复合正极材料,以间苯二酚甲醛树脂作为碳源,研究了固相反应的合成温度和合成时间(烧结时间)对产物的影响,通过对样品理化特征分析,颗粒形貌研究,电化学性能测试发现,在600℃烧结3h的样品颗粒粒径细小,颗粒形态较一致,C包覆均匀性好。电化学测试数据:0.2C倍率放电容量121.6 mAh/g,充放电循环20次后容量为110 mAh/g。结果显示在固相法合成过程中,适当提高反应温度并适当延长反应时间,可以有利于晶体结构改善,提高材料的电化学性能。
王志兴[37]等以炭黑作为碳源,研究了固相反应合成法合成LiMnPO4/ C正极材料的影响因素,分析了合成温度和反应时间对材料晶体结构完整性的影响,从而影响材料的电化学性能。
汪燕鸣[38]等用溶胶凝胶法合成了LiMnPO4/C材料,选择月桂酸作为碳源,磷酸三丁酯作反应物和络合物制备出样品。并对样品进行理化性质分析和电化学性能测试,研究显示溶胶凝胶法有利于材料纳米颗粒堆积成为多孔类球形大颗粒,并有助于提高材料振实密度和电化学性能,合成的样品C包覆均匀,在55℃高温和-10℃下具有优良的放电容量。
易惠华[39]等研究了LiMnPO4/C正极材料的制备,理化性质和电化学性能,主要进行了不同碳源的C包覆研究,Fe、Zn、Mg及三种金属联合掺杂对LiMnPO4/C材料的晶体结构、颗粒形态、电化学性能影响的研究。郭粉霞[40]等进行了不同合成方法(固相法、流变相法、水热法)制备LiMnPO4/C正极材料的研究,进行了Fe、Co、V等掺杂制备LiMnPO4/C正极材料的研究,合成了Li3V2(PO4)3/C和LiCoPO4/C正极材料,对合成的样品进行理化分析和颗粒研究,进行电化学性能测试。陈亚芳[41]等研究了固相法、水热法、前驱体方法三种不同方法制备LiMnPO4/C正极材料,合成的样品进行理化性质表征和电化学性能测试,对比了三种方法在制备材料过程中的优缺点,并总结了对材料电化学性能的影响。聂平[42]等进行LiMnPO4/C的溶剂热制备法,Fe、Co金属离子掺杂LiMnPO4/C制成复合正极材料以及复合材料LiMnPO4/MWCNT的研究,并测试了样品电化学性能。
4 展望
聚阴离子磷酸盐类正极材料的改性研究,许多学者已经进行了金属掺杂改性(含多金属的联合掺杂)、不同碳源及多碳源联合包覆(抗坏血酸、葡萄糖、石墨烯、月桂酸等)的研究、不同合成方法或者通过控制合成过程的改性研究等。
未来锂离子电池正极材料电化学性能的改善,将采用多金属复合掺杂并结合碳源包覆、前驱体改性等,向着复合型正极材料方向进行研究;或者是其他正极材料类的改性研究[43]。包括多元正极材料的研究,例如锂硫化合物锂离子电池材料[44],钠硫化合物钠离子电池材料[45],复合硅酸盐类锂离子电池材料[46-48] 等电极材料的研究等。
参考文献:
[1]K. Padhi, K. S. Nanjundaswamy, and J. B. Goodenough. Phospho-olivines as Positive-Electrode Materials for Rechargeable Lithium Batteries. J. Electrochem. Soc, Vol. 144(4), 1997: 1188-1194
[2] Hong-Qiang Wang,Xiao-Hui Zhang,Feng-Hua Zheng. surfactant effect on synthesis of core-shell LiFePO4/C cathode materials for lithium-ion batteries. J Solid State Electrochem 2015,19:187-194
[3] ZHAO Nannan, LI Yongsheng, ZHI Xiaoke, etal. Effect of Ce3+ doping on the properties of LiFePO4 cathode material. JOURNAL OF RARE EARTHS, 34(2), 2016: 174-180
[4]倪江锋,周恒辉,陈继涛等,金属氧化物掺杂改善LiFePO4电化学性能.无机化学学报,2005,21,4:472-476.
[5]钟美娥,周震涛,林学好.橄榄石型 LiFePO4的掺锰改性研究.电池工业,2009,14(3):202-205
[6] Chung H T, Jang S K, Ryu H W, et al. Effects of nano-carbon webs on the electrochemical properties in LiFePO4/C composite [J]. Solid State Commun, 2004,131(8): 549-554.
[7] 常晓燕,王志兴,李新海,等. 锂离子蓄电池正极材料Li Mn1-xFexPO4的合成与性能 [J]. 电源技术, 2005, 29(10):644-647.
[8] 杨蓉,宋晓平,姚秉华,等. 正极材料磷酸亚铁锂的共沉淀合成和 Mn2+掺杂的研究[J]. 西安理工大学学报, 2006, 22(1): 82-84.
[9] 胡勤琴, 周震涛. Li Mn0.6Fe0.4PO4掺碳改性的研究 [J]. 电池,2007,37(1):38-40.
[10] Mi C H, Zhang X G, Zhao X B, et al. Synthesis andperformance of Li Mn0.6Fe0.4PO4/ nano -carbon [J]. MaterialsScience and Engineering B, 2006, 129: 8-13.
[11] Nakamura T, Sakumoto K, Okamoto M, et al. Electrochemicalstudy on Mn2+-substitution in Li Fe PO4olivine compound [J] .Journal of Power Sources, 2007, 174(2):435-441.
[12] Chang X Y, Wang Z X, Li X H, et al. Synthesis and performance of LiMn0.7Fe0.3PO4 cathode material for lithium ion batteries [J]. Materials Research Bulletin, 2005, 40:1513-1520.
[13] 宋士涛,邓小川,孙建之,等.锂离子电池正极材料Li(MnxFe1-x)PO4的合成及电化学性能的研究 [J]. 功能材料,2005, 36(12): 1941-1943.
[14]Qiao-Ying Huang, Zhi Wu, Jing Su, etal. Synthesis and electrochemical performance of Ti–Fe co-doped LiMn PO4/C as cathode material for lithium-ion batteries. Ceramics International 42 (2016) 11348–11354.
[15]庄大高,赵新兵. 锂离子电池正极材料LiFePO4的合成及电化学性能的研究.浙江大学,2006.
[16]SUN Yu-Heng,LIU Dong-Qiang,YU Ji, et al, Synthesis and Electro-Chemical Properties of Ti-doped Non-stoichiometric LiFePO4 for Lithium-ion Battery Application. CHINESE JOURNAL OF INORGANIC CHEMISTRY, 2006,22 ,9:1711-1714
[17]LianLiang Wang,Pei Hua Ma,Kun Zhang, etal. Hydrothermal synthesis of silver embedded LiFePO4/C. J.Chil.Chem.Soc.55(2),2010:176-178
[18] Kwang Joo Kim*, Jung Han Lee, Tae Young Koh, etal. Improved cyclic stability by octahedral Co3+ substitution in spinel lithium manganese oxide thin-film cathode for rechargeable microbattery. Electrochimica Acta 200(2016) 84-89.
[19]K. Rajammal, D. Sivakumar, Navaneethan Duraisamy, et al. Structural and electrochemical characterizations of LiMn1-xAl0.5xCu0.5xPO4(x=0.0, 0.1, 0.2) cathode materials for lithium ion batteries. Materials Letters 173 (2016) 131-135.
[20] J. Chen, S. Wang, and M. S. Whittingham, “Hydro-thermal synthesis of cathode materials,” Journal of Power Sources.2007,174, 2: 442–448.
[21]ZHOU Min, QIAN Jiang Feng, CAO Yu Liang .et al. Low temperature hydrothermal synthesis and electrochemical performances of LiFePO4 microspheres as a cathode material for lithium-ion batteries. New Energy Materials, 2012, 57(32): 4164–4169
[22]Arun Kumar,R. Thomas,N. K. Karan,etal. Structural and Electrochemical Characterization of Pure LiFePO4 and Nanocomposite C-LiFePO4 Cathodes for Lithium Ion Rechargeable Batteries. Journal of Nanotechnology. 176517,2009:1-10.
[23] Z. Xu, L. Xu, Q. Lai, and X. Ji, Micro-emulsion synthesis of Li Fe PO4/C and its electrochemical properties as cathode materials for lithium-ion cells, Materials Chemistry and Physics, 2007,105,1: 80–85,.
[24] H.-C. Kang, D.-K. Jun, B. Jin, et al., Optimized solid-state synthesis of LiFePO4 cathode materials using ball-milling, Journal of Power Sources, 2008, 179(1):340–346,.
[25]Bang-Kun Zou, He-Yang Wang, Zi-Yue Qiang, etal. Mixed-carbon-coated LiMn0.4Fe0.6PO4 nanopowders with excellent high rate and low temperature performances for lithium-ion batteries. Electrochimica Acta:196(2016):377-385
[26] J. D. Wilcox, M. M. Doeff, M. Marcinek, and R. Kostecki, Factors influencing the quality of carbon coatings on LiFePO4, Journal of the Electrochemical Society, 2007,154, 5:389–395,.
[27] Y.-H. Huang, K.-S. Park, and J. B. Goodenough, Improving lithium batteries by tethering carbon-coated LiFePO4 to polypyrrole, Journal of the Electrochemical Society.2006,153, 12:2282–2286.
[28]Kaipeng Wu, Guorong Hu*, Zhongdong Peng, et al. In situ green synthesis of MnFe2O4 reduced grapheme oxide nano-composite and its usage for fabricating high-performance LiMn1/3Fe2/3PO4 reduced graphene oxide/carbon cathode material for Li-ion batteries. Electrochimica Acta 196 (2016):252–260.
[29]桑俊利, 王巧娟,郭西凤.磷酸铁锂正极材料的合成与表征技术.无机盐工业,2008,40(2):13-16
[30] R.V.Apraksin, S.N.Eliseeva, E.G.Tolstopjatova, et al. High-rate performance of LiFe0.4Mn0.6PO4 cathode materials with poly(3,4-ethylenedioxythiopene): Poly (styrene sulfonate)/carboxymethyl cellulose. Materials Letters 176 (2016) 248-252.
[31]Ye Hong, Zilong Tang, Wei Quan et al. Controllable synthesis of LiMnPO4 nanocrystals: Morphology evolution and their size-dependent electrochemical properties. Ceramics International 42 (2016) 8769–8778
[32] 寇立琴,陈芳杰,陈丽. 锶掺杂 LiMnPO4/C 正极材料电化学性能的研究. 当代化工,2015,44,10:2286-2293.
[33] 王永强,章冬云,刘艳等. 磷酸锰锂正极材料的可控合成与电化学性能研究. 上海应用技术学院学报(自然科学版), 2013,13,4:285-290.
[34]常晓燕,王志兴,李新海等. 锂离子电池正极材料 LiMnPO4的合成与性能.物理化学学报, 2004,20,10:1249-1252.
[35] 朱彦荣,谢颖,伊廷锋等. 锂离子电池正极材料 LiMnPO4/C的电子结构. 无机化学学报, 2013,29,3:523-527.
[36]杨新,刘学武,刘贵昌等. 锂离子电池正极材料 LiMnPO4/C的合成研究.电化学,2011,17,3:306-311.
[37]王志兴,李向群,常晓燕等. 锂离子电池橄榄石结构正极材料 LiMnPO4的合成与性能.中国有色金属学报, 2008,18,4:660-665.
[38]汪燕鸣,王飞,王广健. 溶胶-凝胶法制备 LiMnPO4/C正极材料及其电化学性能. 无机材料学报, 2013,28,4:415-419.
[39]易惠华,戴永年,方海生. 锂离子电池正极材料 LiMnPO4的制备及改性研究. 昆明理工大学, 2012.
[40]郭粉霞,张联齐. 磷酸锰(钴)锂锂离子电池正极材料.天津理工大学, 2014.
[41]陈亚芳,宋光森,王又容. 锂离子电池正极材料磷酸锰锂的合成及改性研究.武汉工业学院,2011.
[42] 聂平,张校刚. 锂离子电池正极材料 LiMnPO4的制备及其电化学性能研究. 新疆大学, 2012.
[43]Tsutomu Ohzuku, Ralph J. Brodd. An overview of positive-electrode materials for advanced lithium-ion batteries. Journal of Power Sources, 2007, 174: 449–456
[44]Linda F. Nazar, Marine Cuisinier, Quan Pang. Lithium-sulfur batteries .Materials Research Society, 2014, 39:436-441
[45]Kei Kubota, Naoaki Yabuuchi ,Hiroaki Yoshida ,et al Layered oxides as positive electrode materials for Na-ion batteries. Materials Research Society, 2014, 39:416-422
[46]Mohammad Mahdi Kalantarian, Sirous Asgari, Doretta Capsoni, et al. An ab initio investigation of Li2M0.5N0.5SiO4(M, N = Mn, Fe, Co Ni) as Li-ion battery cathode materials. Phys. Chem. Chem. Phys, 2013, 15: 8035--8041
[47]Guang He, Guerman Popov, and Linda F. Nazar. Hydrothermal Synthesis and Electrochemical Properties of Li2CoSiO4/C Nanospheres Chem. Mater. 2013, 25:1024−1031
[48]Guohua Zhong,Yanling,Li,Peng Yan,et al. Structural, Electronic, and Electrochemical Properties of Cathode Materials Li2MSiO4(M=Mn, Fe, and Co): Density Functional Calculations. J. Phys. Chem. 2010, 114:3693–3700
(钟万1 张萍1 刘一町1 刘珊珊2 谭铭2 赵红远2 刘兴泉1,2)
(1 四川富骅新能源科技有限公司 四川 绵阳 62100)
(2 电子科技大学新能源材料与器件研究中心 四川 成都 610054)


